(図1 新潟医学会雑誌掲載予定)
|
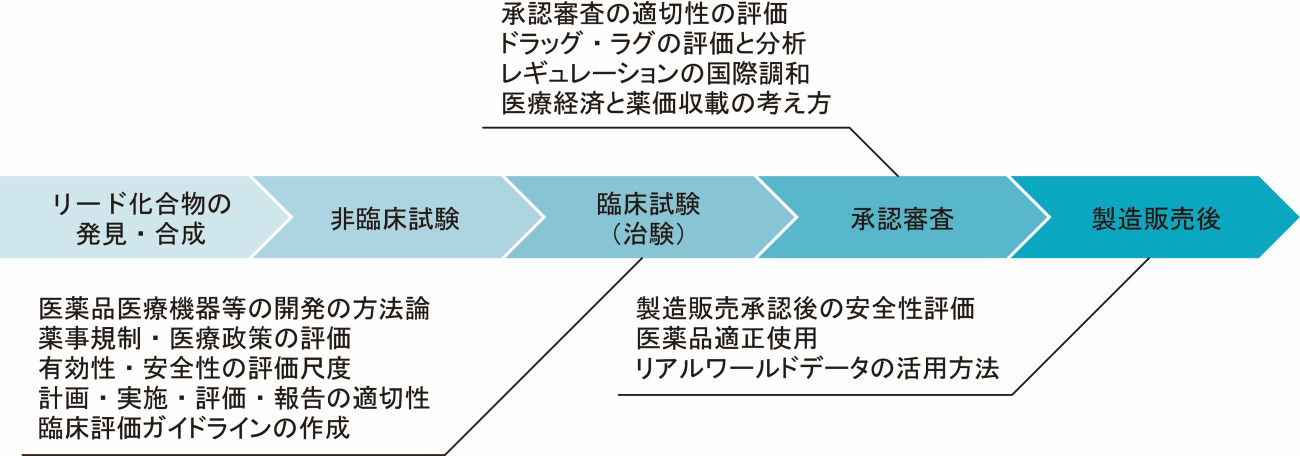
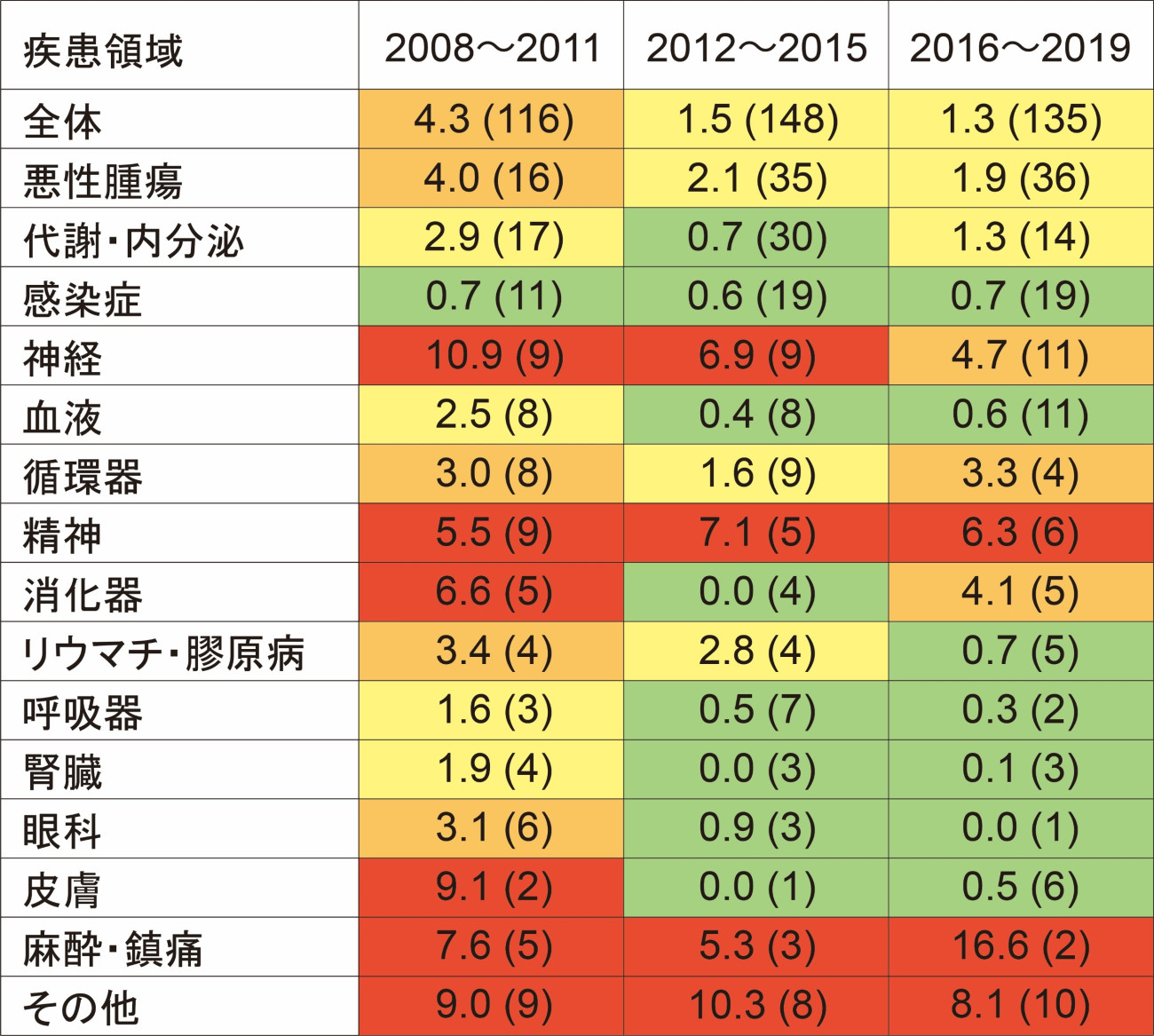
| ドラッグ・ラグは、海外で承認されている医薬品が本邦で承認されるまでの遅れのことであり、患者の立場からは、海外では有効な医薬品が使用可能であるのに本邦では治療が受けられないことを意味します。新薬の多くは欧米で先に承認され、本邦で遅れて承認されることが古くから指摘され、ドラッグ・ラグは、本邦の医療上の課題として、長らく問題視されてきました。厚生労働省及び医薬品医療機器総合機構は、種々の優先審査制度を打ち出すとともに、新薬の審査期間を劇的に短縮しましたが、ドラッグ・ラグが実際にどの程度短縮されたかは不明でした。そこで、我々は、本邦で承認された新薬について検討し、新薬全体のドラッグ・ラグは、審査期間の短縮と国際共同治験の増加によって大幅に改善しているものの、疾患領域別でみると、神経・精神・新薬承認数の小さい領域のように開発が難しい領域では、大きなドラッグ・ラグが未だに残存していることを明らかにしました(図2)。 |
 (図2 Tanaka et al. Clin Pharmacol Ther. 2021より改変)
|